Figura 73

Tonómetro de Aplanación de Goldmann. Instrumento más utilizado para estimar la presión intraocular; calcula la fuerza necesaria para aplanar un área conocida de la córnea.
Coordinador: Dr. Jaime Lozano Alcázar
Glaucoma
Dr. Gian Franco Díez Cattini
Se conoce como glaucoma al grupo de enfermedades que presentan una neuropatía óptica anterior caracterizada por la pérdida progresiva de fibras nerviosas de las células ganglionares,1 que es evidente clínicamente por un aumento de la excavación de la papila óptica y que va acompañada de pérdida del campo visual.
El glaucoma es la causa más común de ceguera irreversible a nivel mundial y la segunda causa general de ceguera.2 La mayoría de los casos de glaucoma en el mundo no están diagnosticados, en parte por ser una enfermedad asintomática pero también porque las estrategias de detección no son eficientes, aun en países de altos ingresos, en donde el 50% de los pacientes con glaucoma desconocen su diagnóstico.3
Existen diferentes tipos de glaucoma según su presentación clínica y sus causas (Cuadro 4). El glaucoma primario de ángulo abierto y la enfermedad por cierre angular son los más prevalentes en el mundo occidental y oriental, respectivamente.
| Cuadro 4. Clasificación general del glaucoma | ||
| Glaucomas primarios | Glaucomas secundarios | |
| Ángulo iridocorneal ABIERTO | Glaucoma primario de ángulo abierto | Glaucoma por pseudoexfoliación |
| Glaucoma de tensión normal | Glaucoma pigmentario | |
| Glaucoma juvenil | Glaucoma inducido por glucocorticoides | |
| Glaucoma congénito primario | Glaucoma por hipertensión venosa epiescleral | |
| Glaucoma secundario a trauma* | ||
| Glaucoma facolítico | ||
| Ángulo iridocorneal CERRADO | Enfermedad por cierre angular
|
Glaucoma facomórfico |
| Glaucoma uveítico* | ||
| Glaucoma neovascular* | ||
| Síndrome de Iris en meseta | Síndromes iridocorneoendoteliales | |
| Disgenesias del segmento anterior | Glaucomas secundarios a tumores/quistes | |
| *Pueden presentarse con ángulo abierto o cerrado dependiendo del estadio clínico. | ||
| Clasificación de los glaucomas según sus causas (primarios y secundarios) y según el estado de la apertura angular (ángulo abierto y ángulo cerrado). Autor: Dr. Gian Franco Díez Cattini. | ||
El mecanismo patológico final de todos los casos de glaucoma es la muerte de las células ganglionares de la retina, que provoca atrofia de la capa de fibras nerviosas y de la cabeza del nervio óptico.
En la mayoría de los casos se reconoce un aumento de la presión intraocular ocasionado por dificultad en el drenaje adecuado del humor acuoso asociado con alteraciones ultraestructurales, moleculares o mecánicas, y que ejerce estrés mecánico sobre la lámina cribosa y las fibras nerviosas que pasan a través de ella.
La pérdida del campo visual asociada a glaucoma sucede característicamente en forma arqueada y suele iniciar en la periferia, ubicando topográficamente la localización del daño a nivel de la cabeza del nervio óptico, en donde las fibras axonales de las células ganglionares rotan 90° para pasar a través de los poros de la lámina cribosa, de forma que los axones provenientes de la retina más periférica yacen en la porción más externa del nervio óptico, en donde las fuerzas mecánicas de rotación ejercen mayor compresión.4 Modelos animales sugieren que existe alargamiento axonal, acumulación de mitocondrias y una alteración metabólica celular causada por el estrés al poco tiempo de inducir elevaciones artificiales de la presión intraocular.
También se han estudiado componentes vasculares, inmunológicos e inflamatorios en la fisiopatología de la pérdida visual glaucomatosa, lo que sugiere que existen otros factores que aceleran o promueven la pérdida de células ganglionares aun en ausencia de elevaciones de la presión intraocular, como ocurre en los casos de glaucoma de tensión normal, en donde la asociación con factores vasculares es más evidente.5
La evaluación del paciente con glaucoma debe iniciar por la identificación de factores de riesgo relevantes, como son:
Edad. La incidencia del glaucoma aumenta con la edad de la población estudiada y se considera actualmente el factor de riesgo no modificable más importante.
Raza. La prevalencia de glaucoma de ángulo abierto es hasta cuatro veces mayor en pacientes de ascendencia africana (6-8%), además de tener una presentación más severa.6 En población hispánica tiene una menor prevalencia (4.74%), pero aun mayor que en blancos (1.5-2%).7 El glaucoma de ángulo cerrado es más común en población de origen asiático.8
Historia familiar: la historia familiar de glaucoma aumenta el riesgo individual de desarrollar la enfermedad entre 5 y 10 veces.9 Se han encontrado alteraciones genéticas en el 4-6% de la población con glaucoma.10
Sexo. La incidencia del glaucoma de ángulo abierto es igual en hombres y mujeres, sin embargo, la enfermedad por cierre angular es más común en mujeres.
Grosor corneal central disminuido: el estudio Ocular Hypertension Treatment Study demostró que el grosor corneal central menor a 555 µm aumenta el riesgo de conversión y progresión en glaucoma de ángulo abierto.11
La presión intraocular está determinada por la tasa de producción de humor acuoso y la resistencia a la salida del mismo por las vías de salida convencional (trabecular) y no convencional (uveoescleral).12
La hipertensión ocular es el factor de riesgo más importante para desarrollar glaucoma, sin embargo, existen pacientes con presiones intraoculares elevadas que nunca desarrollan neuropatía óptica glaucomatosa.
El humor acuoso es un ultrafiltrado del plasma que se produce a una tasa promedio de 2.5 µL/min en el cuerpo ciliar, sale hacia la cámara posterior y pasa a la cámara anterior a través de la pupila para ser eliminado por la malla trabecular y el canal de Schlemm (vía convencional) y a través de los haces musculares del músculo ciliar y el espacio supracoroideo (vía uveoescleral).
La tonometría es la medición de la presión intraocular. El tonómetro más utilizado es el tonómetro de aplanación de Goldmann (Figura 73). El rango de presión intraocular normal es de 10 a 21 mm Hg con una variación diurna de hasta 6 mm Hg. Es más alta en las primeras horas de la mañana y más baja durante el sueño.13
Figura 73

Tonómetro de Aplanación de Goldmann. Instrumento más utilizado para estimar la presión intraocular; calcula la fuerza necesaria para aplanar un área conocida de la córnea.
La gonioscopia es la maniobra clínica que permite la visualización de las estructuras que componen el ángulo iridocorneal. El reconocimiento de las características angulares permite la clasificación de los glaucomas en: glaucomas de ángulo abierto y glaucomas con cierre angular.
En un ángulo normal, deben identificarse todas las estructuras siguientes (Figura 74):
Banda del cuerpo ciliar: es la estructura más posterior y corresponde a la cara anterior del cuerpo ciliar. Es una banda de grosor variable de color rojizo o café.
Espolón escleral: corresponde a la proyección anterior de la esclera en donde se inserta la porción longitudinal del músculo ciliar.
Malla trabecular: tiene una porción anterior no funcional ni pigmentada, y una porción más posterior, funcional y pigmentada.
Línea de Schwalbe: es una línea opaca que demarca la terminación periférica de la membrana de Descemet. Es la porción más anterior del ángulo iridocorneal.
En un ángulo estrecho pueden verse sólo la porción anterior del trabéculo, la línea de Schwalbe, o ninguna de ellas. Otros hallazgos que pueden encontrarse son: sinequias anteriores periféricas, pigmentación excesiva y neovascularización.
Figura 74
![Gonioscopia de un ángulo abierto. Se muestran las estructuras angulares de anterior a posterior. [LS, línea de Schwalbe; MT, malla trabecular; EE, espolón escleral; BC, banda del cuerpo ciliar.]](img/fig06_74.jpg)
Gonioscopia de un ángulo abierto. Se muestran las estructuras angulares de anterior a posterior. [LS, línea de Schwalbe; MT, malla trabecular; EE, espolón escleral; BC, banda del cuerpo ciliar.]
Clínicamente pueden distinguirse dos porciones: el anillo neurorretiniano, que corresponde a los haces de fibras nerviosas acomodadas en la periferia de la apertura escleral, y la excavación o copa, que es la depresión fisiológica central que dejan los mismos axones. Se describe en relación al tamaño total del disco ―relación copa/disco― y se considera normal si es menor del 30-50% (Figura 75).
Figura 75
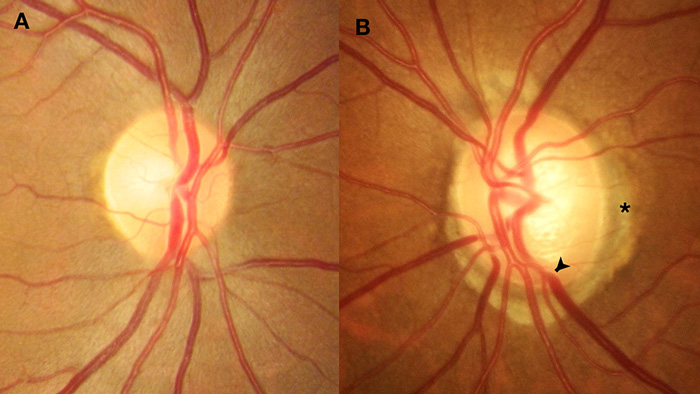
Examinación del disco óptico. A, Disco óptico sano de bordes definidos y relación copa/disco de 40%. B, Disco óptico glaucomatoso, es evidente un aumento de la relación copa/disco, con pérdida del anillo neurorretiniano en el polo inferior con desplazamiento vascular (cabeza de flecha) y atrofia de la retina peripapilar (asterisco).
Los cambios morfológicos del disco característicos de glaucoma son: la pérdida focal o generalizada del anillo neurorretiniano con aumento de la excavación de predominio superior e inferior, palidez, desplazamiento vascular y atrofia de la retina peripapilar.
La presencia de hemorragias del disco óptico en forma de astilla deben levantar un alta sospecha de glaucoma, ya que aunque no son exclusivas del glaucoma, son extremadamente raras en ojos sanos.
La medición objetiva, precisa y reproducible de la capa de fibras nerviosas peripapilar, del anillo neurorretiniano y de la excavación, es posible en la actualidad mediante la adquisición de imágenes por medio de tomografía de coherencia óptica (OCT). La tecnología de OCT mide la reflexión de un haz de luz desde los tejidos oculares para obtener secciones transversales que pueden ser analizadas, comparadas y almacenadas. El análisis automatizado de estas imágenes compara los datos obtenidos con bases normativas compuestas por imágenes de sujetos sanos, permitiendo clasificar los resultados como normal, anormal o limítrofe según su desviación estadística.
La perimetría evalúa la extensión y la sensibilidad diferencial del sistema visual; desde la retina hasta la corteza occipital. El campo visual se describe como una “isla de visión” y se refiere a la porción de espacio desde la cual la luz puede entrar al ojo, estimular la retina y desencadenar la propagación de señales eléctricas que son guiadas a través del nervio óptico hasta el área visual primaria.
La pérdida del campo visual no es exclusiva del glaucoma y puede observarse en patologías de cualquier porción de la vía visual. Los hallazgos característicos de glaucoma son los escotomas arqueados en los 15-30° centrales (escotoma de Bjerrum), escotomas confluyentes con la mancha ciega (escotoma de Seidel), y los localizados en el campo visual nasal (escalón nasal) [Figura 76].
Figura 76
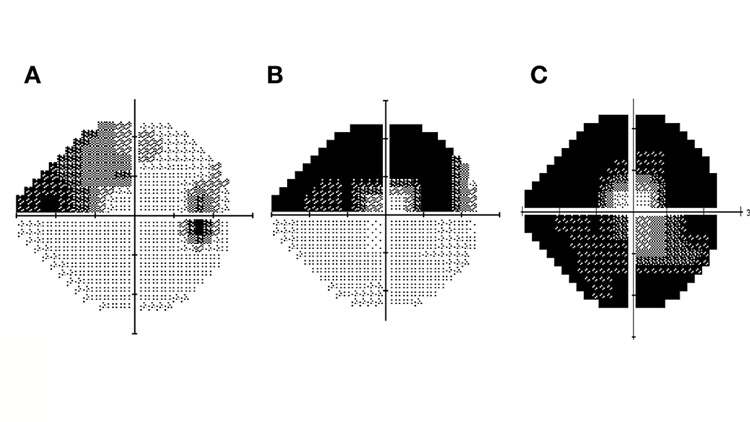
Defectos perimétricos característicos de glaucoma. A, Escalón nasal superior que se extiende hacia el área de Bjerrum. B, Escotoma arqueado superior que respeta área foveal. C, Daño tubular avanzado sin involucro foveal.
Síntomas. El glaucoma es generalmente una enfermedad asintomática. En los casos que se acompañan de elevación súbita de presión intraocular puede aparecer dolor y baja visual.
Signos. Los signos clínicos característicos de los glaucomas más comunes se resumen en el Cuadro 5:
| Cuadro 5. Características clínicas de los glaucomas | |||||
| Glaucoma primario de ángulo abierto | Glaucoma de tensión normal | Enfermedad por cierre angular | Cierre angular agudo | Glaucoma neovascular | |
| Sexo | H = M | H = M | M > H | M > H | H = M |
| Raza | Negros e hispanos | Japoneses | Asiáticos | Asiáticos | Sin predilección |
| PIO | Elevada | Elevada | Variable | Muy elevada | Muy elevada |
| Ángulo | Abierto | Abierto | Cerrado | Cerrado | Abierto (inicial) Cerrado (final) |
| NOG | Sí | Sí | Depende del estadio clínico | Se desarrolla si no se resuelve pronto | Se desarrolla si no se resuelve pronto |
| Otros | No |
|
|
|
|
| Datos generales de los cuadros más comunes de glaucoma. [H, hombres; M, mujeres; PIO, presión intraocular; NOG, neuropatía óptica glaucomatosa.] Autor: Dr. Gian Franco Díez Cattini. | |||||
La reducción sostenida de la presión intraocular es la única maniobra terapéutica que ha demostrado disminuir la tasa de progresión del daño glaucomatoso.14 Las herramientas que permiten hacerlo de manera eficaz son:
Tratamiento médico: existen al menos seis familias de medicamentos hipotensores en la actualidad; siendo los de primera línea los análogos de prostaglandinas, seguidos de los beta-bloqueadores, inhibidores de anhidrasa carbónica, agonistas alfa adrenérgicos, mióticos y los nuevos inhibidores de la enzima Rho-kinasa.
Láser: la trabeculoplastia selectiva para los glaucomas de ángulo abierto, y la iridotomía periférica para los glaucomas primarios de ángulo cerrado son los más comunes.
Procedimientos quirúrgicos: la trabeculectomía, en la que se hace una comunicación de la cámara anterior al espacio subconjutival por medio de una fístula y los dispositivos de drenaje que lo hacen a través de un tubo de silicona. En los últimos años ha surgido un grupo de procedimientos conocidos como MIG (Minimally invasive glaucoma surgery) con un alto perfil de seguridad y eficacia.15
Si no se diagnostica, el glaucoma conduce a la ceguera. El diagnóstico oportuno es la maniobra más importante para prevenir la progresión de la enfermedad y la discapacidad visual asociada.