Figura 39
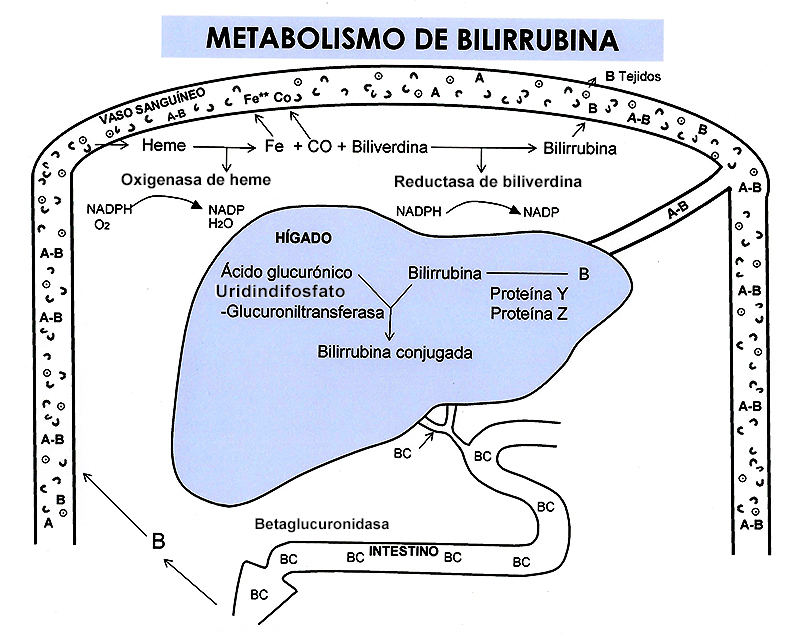
Metabolismo de la bilirrubina
Coordinador: Dr. Miguel Ángel Rodríguez Weber
Ictericia neonatal
M. en C. Carlos López Candiani
La ictericia es el signo clínico más frecuente en el recién nacido; es la primera causa de hospitalización después de que un neonato ha sido dado de alta posterior al nacimiento. En el Instituto Nacional de Pediatría de la Ciudad de México, la ictericia patológica es la causa más frecuente de egreso hospitalario desde hace decenios. Se considera que alrededor de 65 a 70% de todos los recién nacidos presentan ictericia y casi todos los nacidos pretérmino la tendrán.
En la mayoría de los neonatos a término se trata de un evento fisiológico neonatal que dura de tres a cinco días, pero existen factores que la incrementan patológicamente. La función del médico es determinar si la ictericia es fisiológica o patológica, en cuyo caso deberá realizar estudios y tratamiento.
Se le llama ictericia a la coloración amarilla de la piel y escleróticas. Frecuentemente se usa en forma indistinta el término de hiperbilirrubinemia, el cual significa un incremento en el nivel de bilirrubinas en sangre respecto a los valores normales en el adulto, de 1.5 mg/dL (26 µmol/L). Aunque la ictericia sea causada por bilirrubinas elevadas, no son sinónimos; el primero es un signo clínico, es decir, lo que observamos en el paciente, y el segundo es un término bioquímico, no podemos ver la cantidad de bilirrubina. En los recién nacidos puede verse ictericia con aproximadamente 5 mg/dL (86 µmol/L) de bilirrubina total, aunque en pacientes de piel oscura, puede ser detectada por el médico hasta que llega a 8 mg/dL. Por supuesto, la experiencia del médico es importante; algunos padres a menudo no se han dado cuenta de que su bebé presenta ictericia con niveles de bilirrubina superiores a 15 mg/dL.
Alrededor de 70-80% de la bilirrubina proviene del grupo heme de la hemoglobina contenida en los eritrocitos. La bilirrubina restante proviene de la mioglobina y de algunas enzimas como catalasas y citocromos. La Figura 39 muestra el metabolismo de la bilirrubina.
En forma fisiológica, un eritrocito que envejece es destruido al pasar por el sistema reticuloendotelial del bazo, hígado y médula ósea, donde se liberan las sustancias contenidas en él. La hemoglobina es una proteína que contiene un grupo heme y globina; el grupo heme es anillo pirrólico que transporta al oxígeno en el aparato circulatorio. Cuando la hemoglobina sale del eritrocito, el anillo heme es abierto por efecto de la enzima oxigenasa de heme y se libera una molécula de biliverdina, una de hierro y una de monóxido de carbono (CO). Este último es volátil y al pasar por el pulmón, se elimina con el aire espirado; el hierro sigue en la circulación como parte de las reservas orgánicas y la biliverdina es rápidamente convertida en bilirrubina por la enzima reductasa de biliverdina, con consumo de energía.
La bilirrubina producida es una molécula ácida y liposoluble, por lo que puede pasar fácilmente las membranas celulares (doble capa de lípidos); sin embargo, la mayoría se une a la albúmina, una proteína plasmática de gran tamaño, lo que impide que la bilirrubina penetre a las células; en esta parte del ciclo se le conoce como bilirrubina no conjugada o bilirrubina indirecta. En esta forma no es filtrada por el riñón.
Al pasar por el hígado, la bilirrubina es captada por los hepatocitos mediante transportadores de membrana (bilitranslocasa y otras glicoproteínas); en el citoplasma se transporta por la proteína Y (ligandina) y la proteína Z y es llevada al retículo endoplásmico liso. Allí se conjuga con una molécula de ácido glucurónico por efecto de la enzima uridindifosfato glucuroniltransferasa (UDPGT) produciendo monoglucurónido de bilirrubina (en los adultos, se conjuga con dos moléculas que forman diglucurónido de bilirrubina); en este momento, la bilirrubina toma el nombre de conjugada o de reacción directa. La característica más importante de la bilirrubina conjugada es su hidrosolubilidad, con lo cual puede ser excretada por los líquidos corporales; tiene poca penetración a las células.
La bilirrubina conjugada es excretada hacia los canalículos biliares, formando la bilis junto con otros pigmentos biliares, que a través de las vías biliares intrahepáticas y extrahepáticas, la conducen a la segunda porción del duodeno, donde se mezcla con el contenido intestinal. Al llegar al colon, por efecto de las bacterias intestinales se producen urobilinoides y se excreta en las heces como urobilina y estercobilina. Sin embargo, en las paredes intestinales existe una enzima llamada beta-glucuronidasa intestinal que hidroliza la bilirrubina separándola del ácido glucurónico y permite la absorción nuevamente por el enterocito hacia la circulación como bilirrubina libre. Esta bilirrubina debe unirse nuevamente con la albúmina, pasar por el hígado, conjugarse y excretarse nuevamente; a esto se le conoce como circulación enterohepática de la bilirrubina. La bilirrubina que se absorbe nuevamente sobrecarga el sistema de transporte, conjugación y excreción.
En los recién nacidos se conjunta una serie de factores que hacen que la bilirrubina sea fisiológicamente más elevada que en los adultos. La vida media de los eritrocitos es de 90 días, a diferencia de los 120 días en un adulto. La carga eritrocitaria es mayor en los neonatos; su hemoglobina es de 18 a 21 mg/dL, por lo que más eritrocitos llegarán a su vida útil y producirán una mayor carga de bilirrubina; además lo harán más rápidamente. Las proteínas transportadoras dentro del hepatocito son deficientes en cantidad y además transportan otras sustancias. La enzima glucuroniltransferasa de uridindifosfato también es escasa y con menor actividad que a otras edades; en los adultos la bilirrubina es conjugada con dos moléculas de ácido glucurónico y en el recién nacido sólo con una, por lo que será más fácil revertir la unión a nivel intestinal. La excreción es lenta.
El meconio, por ser espeso y chicloso, permite un tránsito intestinal más lento, dejando a la bilirrubina directa más tiempo expuesta a la betaglucuronidasa intestinal; hay mayor cantidad de esta enzima en los enterocitos de los neonatos que de los adultos; durante los primeros días de vida hay escasas bacterias en colon, por lo que no se producen urobilinoides y la bilirrubina conjugada tendrá mayor posibilidad de absorción; todos estos factores participan en la circulación enterohepática de la bilirrubina.
Como puede deducirse, estos factores en conjunto llevan en el transcurso de la primera semana de vida a un nivel de bilirrubinas entre seis y ocho veces más alto que el nivel normal del adulto. La bilirrubina tiene una función antioxidante potente y es posible que su incremento en los primeros días de vida, justo cuando aumenta la cantidad de oxígeno en sangre, no sea una casualidad; recordemos que el paso de biliverdina, un pigmento no tóxico y excretable por orina, a bilirrubina, tiene un costo energético y sugiere una actividad biológicamente importante del producto.
Adicional a los factores que llevan a elevación de las bilirrubinas en niveles fisiológicos para un recién nacido (menor a 12 mg/dL en un nacido a término), existen factores que incrementan las bilirrubinas a niveles superiores, incluso tóxicos. Siguiendo la fisiología de la bilirrubina, podemos identificar posibles causas de ictericia patológica, se mencionan ejemplos, sin ser limitativos.
Todos los factores que lleven a una mayor destrucción de eritrocitos causarán mayor producción de bilirrubina indirecta, sobrecargando un sistema limitado en su capacidad de conjugación y excreción. La hemólisis puede ser intravascular o extravascular. Dentro de la hemólisis intravascular están las anemias hemolíticas hereditarias como la esferocitosis, eliptocitosis, hemoglobinopatías; deficiencias enzimáticas como deshidrogenasa de glucosa 6 fosfato, piruvatocinasa o hexocinasa. De las anemias hemolíticas adquiridas están principalmente los problemas de isoinmunización materno-fetal; la más frecuente es a sistema ABO pero la más grave es a sistema Rh; hay otros sistemas sanguíneos menores (M, N, Duffy) que rara vez causan ictericia intensa. Otras causas de hemólisis intravascular adquirida incluyen la sepsis grave y algunos medicamentos. La policitemia también es causa de ictericia, dado que un exceso de eritrocitos llegará eventualmente a su vida media y serán destruidos con sobreproducción de bilirrubina.
Cualquier lesión que cause salida de sangre del circuito vascular generará bilirrubina indirecta, dado que los eritrocitos serán destruidos y se liberarán sus productos. Así pues, los casos de trauma obstétrico con grandes equimosis, cefalohematoma, sangrado de tubo digestivo, hemorragia cerebral o en cualquier órgano interno son factores que harán la ictericia más intensa (Cuadro 34).
| Cuadro 34. Causas de hiperbilirrubinemia no conjugada | ||
| A. Aumento en la producción | ||
| 1. Hemólisis intravascular | a) Congénita | • Anormalidades eritrocitarias: esferocitosis, eliptocitosis, picnocitosis • Deficiencias enzimáticas: deshidrogenasa de glucosa 6 fosfato, hexocinasa, piruvato cinasa • Hemoglobinopatías |
| b) Adquirida | • Isoinmunización materno fetal: ABO, Rh, M, N, Duffy • Poliglobulia • Medicamentos |
|
| 2. Hemólisis extravascular | • Equimosis • Hemorragia cerebral • Hemorragias internas |
|
| B. Alteraciones en el transporte | ||
| 1. Plasmático | • Hipoalbuminemia • Desplazamiento de la albúmina por medicamentos y grasas |
|
| 2. Citoplasmático | • Deficiencia de proteínas Y y Z | |
| C. Alteraciones en la conjugación | ||
| 1. Ausencia congénita del sistema UDPGT (Crigler-Najjar tipo I) | ||
| 2. Deficiencia congénita del sistema UDPGT (Crigler-Najjar tipo II) | ||
| 3. Disminución congénita de la actividad de la UDPGT (Gilbert) | ||
| 4. Inhibición de la UDFGT (Lucey-Driscoll, Gardner-Arias, medicamentos) | ||
| 5. Disminución adquirida de actividad: hipotiroidismo, hipoxia, hipotermia | ||
| D. Circulación enterohepática | ||
| 1. Ayuno | ||
| 2. Íleo | ||
| 3. Tapón meconial | ||
| 4. Atresia intestinal | ||
| 5. Deglución de sangre materna | ||
Como se dijo anteriormente, la albúmina es el transportador plasmático de la bilirrubina no conjugada. Cuando existe bajo contenido de albúmina en sangre, o cuando la albúmina está ocupada por otras sustancias que también se unen a la albúmina, puede haber un desplazamiento de la bilirrubina. Esto generará por un lado, una menor captación por el hígado para su metabolismo natural, pero por otro lado, dejará a la bilirrubina ácida libre con la potencialidad de penetrar a las células, en donde puede interferir con sistemas energéticos y ser tóxica, principalmente en el sistema nervioso central, como se verá más adelante.
Dentro de las causas potencialmente más graves de ictericia neonatal, están las alteraciones en la conjugación. La UDPGT puede estar congénitamente deficiente o ausente (síndrome de Crigler- Najjar). También puede estar bloqueada por otras sustancias, tanto en el periodo neonatal como más adelante.
Cualquier factor que obstruya el flujo biliar lleva a un incremento de bilirrubina ya conjugada; esto se conoce como síndrome colestásico y se manifiesta por ictericia, hipocolia y coluria. Las causas de colestasis pueden ser alteraciones anatómicas de vías biliares intrahepáticas o extrahepáticas, como síndromes de Alagille o la enfermedad de Caroli, o pueden ser por obstrucción funcional como en la hepatitis neonatal de células gigantes (no infecciosa), hepatitis viral o hepatitis séptica. La nutrición parenteral prolongada también es causa frecuente de colestasis en recién nacidos.
Existe un grupo de enfermedades que causan disminución de la conjugación y disminución de la excreción; en estos casos se eleva tanto la bilirrubina indirecta como la directa. Estas enfermedades generalmente son metabólicas e incluyen la deficiencia de alfa 1- antitripsina, hipotiroidismo, tirosinemia y muchas otras (Cuadro 35).
| Cuadro 35. Causas de hiperbilirrubinemia conjugada y mixta | |||||
| A. Colestasis obstructiva | |||||
| 1. Atresia de vías biliares | |||||
| 2. Enfermedad de Alagille | |||||
| 3. Enfermedad de Caroli | |||||
| 4. Páncreas anular | |||||
| 5. Quiste de colédoco | |||||
| 6. Colangitis esclerosante neonatal | |||||
| 7. Bilis espesa | |||||
| B. Colestasis hepatocelular | |||||
| 1. Hepatitis neonatal idiopática | |||||
| 2. Infección viral: virus de la hepatitis, citomegalovirus, inmunodeficiencia humana | Virus de la hepatitis, citomegalovirus, inmunodeficiencia humana | ||||
| 3. Infección bacteriana: sepsis, sífilis, infección del tracto urinario | Sepsis, sífilis, infección del tracto urinario | ||||
| 4. Alteraciones metabólicas | • Deficiencia de antitripsina alfa-1 • Tirosinemia • Galactosemia • Fructosinemia • Hipotiroidismo • Fibrosis quística • Glucogenosis tipo IV • Hemocromatosis • Enfermedad de Gaucher • Enfermedad de Byler |
||||
| C. Tóxica | |||||
| 1. Nutrición parenteral | |||||
| Fuente: Referencias. | |||||
Los eventos que disminuyan el tránsito intestinal permitirán una exposición prolongada de la bilirrubina conjugada a la glucuronidasa beta intestinal, generando mayor absorción de bilirrubina no conjugada. Dentro de estas causas está el íleo de cualquier tipo, atresia intestinal, tapón meconial e incluso la deglución de sangre materna.
Como suele suceder con el abordaje de todos los problemas médicos, lo primero es realizar una buena historia clínica. Antecedentes de importancia incluyen el origen de los padres (la deficiencia de deshidrogenasa de glucosa 6 fosfato es más frecuente en originarios de países mediterráneos), el grupo sanguíneo de la madre, diabetes materna, prematuridad, tabaquismo durante el embarazo (disminuye riesgo), anemias hereditarias, ictericia en hermanos, tíos o padres. Los recién nacidos que tienen otras enfermedades pueden tener mecanismos alterados para metabolizar y/o excretar la bilirrubina normalmente y así más riesgo de ictericia intensa o toxicidad incrementada. Es importante conocer la edad gestacional, el peso al nacimiento, el tipo de alimentación (amamantamiento exclusivo o uso de fórmula), el peso al nacimiento y al momento de la evaluación.
La exploración física minuciosa permitirá detectar tanto otras enfermedades en el recién nacido como posibles datos neurológicos de toxicidad por bilirrubina. La intensidad de la ictericia se evalúa siempre clínicamente; sin embargo, la correlación con los niveles séricos dependerá de la experiencia del explorador. Se sabe que la ictericia aparece siguiendo una secuencia: inicialmente en el cordón umbilical, luego en cara y de allí en forma descendente; los últimos sitios que presentan ictericia son las palmas y las plantas. Kramer dividió el cuerpo en cinco zonas y asignó a cada zona un rango de bilirrubinas probables. Su utilidad es conocer que a partir de la zona III, la bilirrubina puede estar en rango patológico, por lo que debe cuantificarse con estudios de laboratorio.
En neonatos enfermos, con factores de riesgo, prematuros y en aquéllos con ictericia intensa o en zonas de Kramer III a V, se deben realizar estudios de laboratorio que a continuación se mencionan.
Permite conocer a través del nivel sérico si se trata de ictericia fisiológica o patológica y en este último caso, evaluar qué tan importante es el problema. Las cifras se deben contrastar con las tablas y gráficas que hay para diferentes edades gestacionales, posnatales y factores de riesgo. La fracción de bilirrubina (conjugada o no) ayuda a identificar la posible alteración fisiopatológica dentro del ciclo de la bilirrubina.
Siempre se deben de tener los sistemas sanguíneos del neonato y de su madre para identificar incompatibilidad a grupo o a Rh. La incompatibilidad sanguínea no garantiza que haya isoinmunización maternofetal y hemólisis, por lo que se deberá complementar con la prueba confirmatoria.
Permite identificar anticuerpos maternos en la sangre del bebé; es diagnóstica de isoinmunización maternofetal en caso de madre Rh negativa, pero en caso de isoinmunización a grupo A o B, puede ser negativa. En este caso, se deberá complementar con una prueba de eluido, en la cual se utiliza la elución mediante alguna técnica física, química o térmica para separar anticuerpos maternos que ya están unidos al eritrocito del neonato. También puede complementarse con la cuantificación de isoaglutininas en sangre materna; los valores diagnósticos son anti-A > 1:1 024 y anti-B > 1:512.
Brinda mucha información, por lo que se debe solicitar concomitantemente con los anteriores. Encontrar anemia es sugestivo de hemólisis (intravascular o extravascular). La tríada de ictericia, anemia y reticulocitosis es diagnóstica de anemia hemolítica. La policitemia también es causa de ictericia intensa. En caso de sepsis neonatal, se puede encontrar leucocitosis (ver cifras para los primeros días de vida) o por el contrario, leucopenia (< 5 000 leucocitos/mm3); también la trombocitopenia por debajo de 100 000 es sugestiva de infección grave.
Existen dos tipos de ictericia asociada a lactancia materna exclusiva. El primer tipo se observa en neonatos alrededor del cuarto a sexto días cuyas madres tienen una producción escasa de leche y no son complementados con alguna fórmula láctea. Los primeros días muestran avidez por la succión, pero conforme pasan los días y no se satisfacen sus demandas hídricas y calóricas, se van deshidratando progresivamente y llegan a los servicios de urgencias con un cuadro de ictericia, deshidratación, hipernatriemia y algunos con hipoglucemia; generalmente muestran gran pérdida de peso respecto al nacimiento, que puede llegar hasta 30%.
No está bien establecida la causa de la ictericia asociada a deficiencia en el amamantamiento, pero se reconoce que la circulación enterohepática juega un papel muy importante así como la deprivación calórica. Queda claro que la leche de su madre no es la causante del cuadro, sino una lactancia no exitosa, por lo que todos los bebés exclusivamente amamantados deben revisarse antes de terminar la primera semana de vida y comparar el peso con el del nacimiento.
El segundo tipo de ictericia sí está asociado con sustancias químicas en la leche de algunas madres que permiten la acumulación de bilirrubina por interferir con el metabolismo natural en uno o varios puntos; el síndrome de Gardner-Arias está incluido aquí. Se han implicado estradiol, ácidos grasos, betaglucuronidasa de la leche y otras sustancias, sin que se haya demostrado cuál de ellas es causante directa. En estos casos, la ictericia inicialmente fisiológica se prolonga más allá de la segunda semana, sin algún dato clínico agregado y generalmente no es necesaria alguna intervención; en forma excepcional llega a niveles peligrosos. Los hijos amamantados de la misma madre tendrán ictericia más allá de la segunda semana y se ha notado que puede prolongarse hasta seis semanas.
Un recién nacido a término sano, que se alimenta bien, con ictericia leve, generalmente cursa con ictericia fisiológica que por supuesto no requiere intervención alguna. Se descarta ictericia fisiológica cuando inicia en las primeras 24 h de vida o la que se prolonga más allá de la segunda semana; la ictericia intensa que excede de la zona II de Kramer y cuando se encuentra elevación de la bilirrubina conjugada. Cualquier neonato con bilirrubina muy elevada, o en incremento rápido, debe ser tratado de inmediato para evitar toxicidad neurológica.
El estándar de tratamiento de la ictericia es la fototerapia. Los fotones de luz penetran la piel y forman isómeros hidrosolubles que pueden excretarse por orina y bilis, sin necesidad de conjugación. Existen tres factores importantes asociados a la efectividad de la bilirrubina: la superficie expuesta, la intensidad de la luz y la longitud de onda. La fototerapia debe darse con el neonato desnudo; para permitir una mayor exposición de la piel a la luz se dobla o recorta el pañal. La intensidad de la luz se mide en microwatts y se ha visto mayor efecto con irradiación de 25 a 35 μW/cm2; las lámparas van perdiendo intensidad conforme se van usando (aunque no se apaguen por completo); las lámparas de halógeno y las de focos fluorescentes de luz blanca o azul especial, duran aproximadamente 2 000 h en uso; después de ese tiempo se mantendrán encendidas y sin cambio al ojo humano, pero no serán efectivas en reducir la ictericia, por lo que se debe llevar un control de su uso y cambiarse al cumplir la vida establecida como útil para tratamiento de ictericia, aun cuando emitan luz.
La longitud de onda es percibida por el ojo humano como color; la más útil para tratamiento de ictericia es la de 460-490 nm y corresponde al espectro azul. Los estudios han demostrado que la fototerapia de luz fluorescente, la de halógeno, la de fibra óptica y la de diodo emisor de luz son útiles para el tratamiento de la ictericia neonatal con efectos muy similares. Las lámparas de LED duran 30 000 h.
En caso de que los niveles de bilirrubina sérica total sean muy elevados para la edad gestacional y horas de vida, podrá estar indicada una exsanguinotransfusión, sobre todo si hay factores de riesgo para daño neurológico (ver más adelante). Ésta consiste en extraer sangre del paciente y simultáneamente transfundir sangre reconstituida de donante. Se calcula a dos veces el volumen sanguíneo: tomando en consideración que un neonato tiene de sangre circulante aproximadamente 80 mL/kg de peso, entonces el volumen de recambio será el peso en kilogramos por 160 mL; en un niño de 3 kg de peso se deberá solicitar 480 mL de sangre.
Cuando se hace por una sola vía (catéter venoso central), se necesita extraer una alícuota de sangre a 5 mL/kg y luego transfundir la misma cantidad de sangre reconstituida; se repite el procedimiento hasta agotar el volumen calculado. Este método irremediablemente permitirá que una parte de la sangre que recién se introdujo por el catéter se extraiga nuevamente en cada recambio, por lo que suele ser ligeramente menos efectivo que cuando se realiza por dos vías. En caso de que el neonato presente datos neurológicos atribuibles a bilirrubina (descritos más adelante) se deberá realizar exsanguinotransfusión urgente, sin importar los valores séricos de bilirrubina.
Para el inicio del tratamiento es necesario tomar en consideración, además de los niveles séricos de bilirrubina sérica total, los siguientes factores:
Existen gráficas y tablas para diferentes edades gestacionales que muestran los límites de bilirrubina sérica total que se pueden tolerar y los valores a los cuales se debe iniciar fototerapia o realizar una exsanguinotransfusión. La American Academy of Pediatrics publicó sus criterios de tratamiento para neonatos de 35 semanas o más de gestación y se pueden consultar texto y gráficas gratuitamente en https://pediatrics.aappublications.org/content/114/1/297; se observará que existen diferentes curvas y se utilizará la adecuada dependiendo de la edad gestacional y si hay o no factores de riesgo asociados. En 2009 hizo una actualización, también disponible en texto completo; se recomienda al lector interesado revisar la publicación de 2004 dado que ofrece mayor información (Figuras 40 y 41).
Figura 40
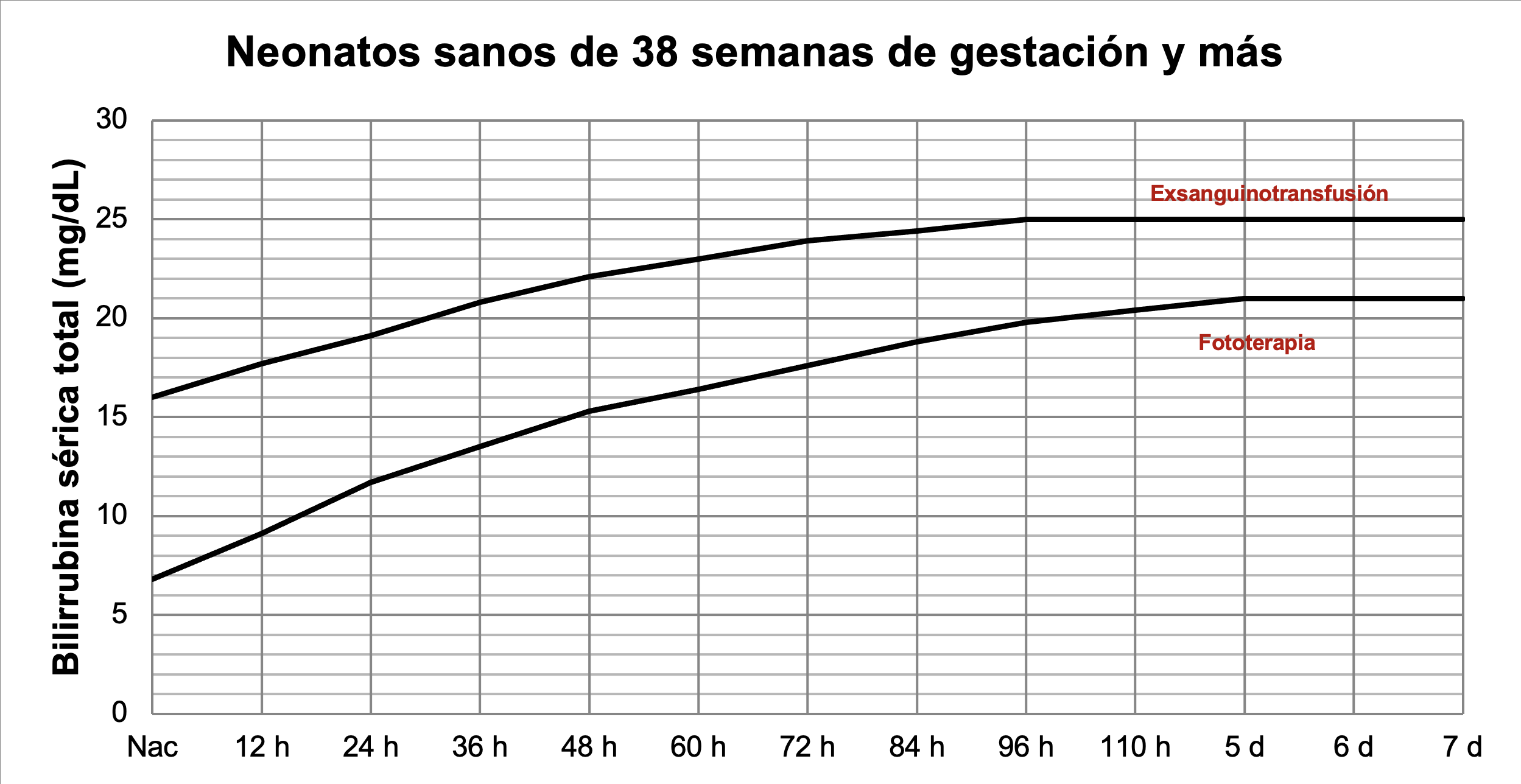
Tratamiento de ictericia en neonatos sanos de 38 semanas y más. A partir de datos de la AAP.
Figura 41
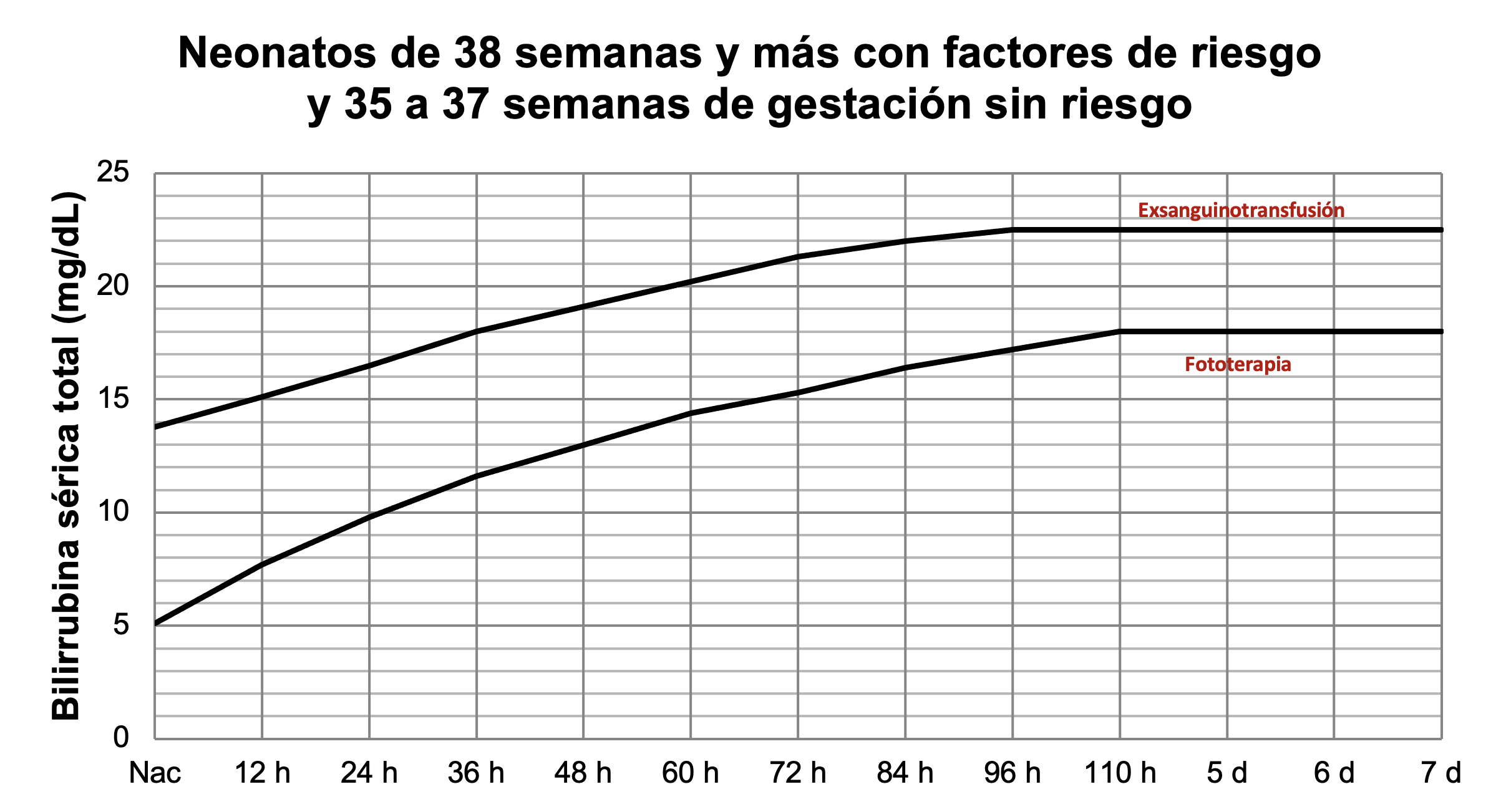
Tratamiento de ictericia en neonatos de 38 semanas y más con factores de riesgo, o de 35 a 38 semanas sanos. A partir de datos de la AAP.
Para neonatos pretérmino existen diferentes guías. Las Figuras 42 a 45 muestran los valores de bilirrubina para indicar fototerapia o exsanguinotransfusión en neonatos pretérmino.
Figura 42
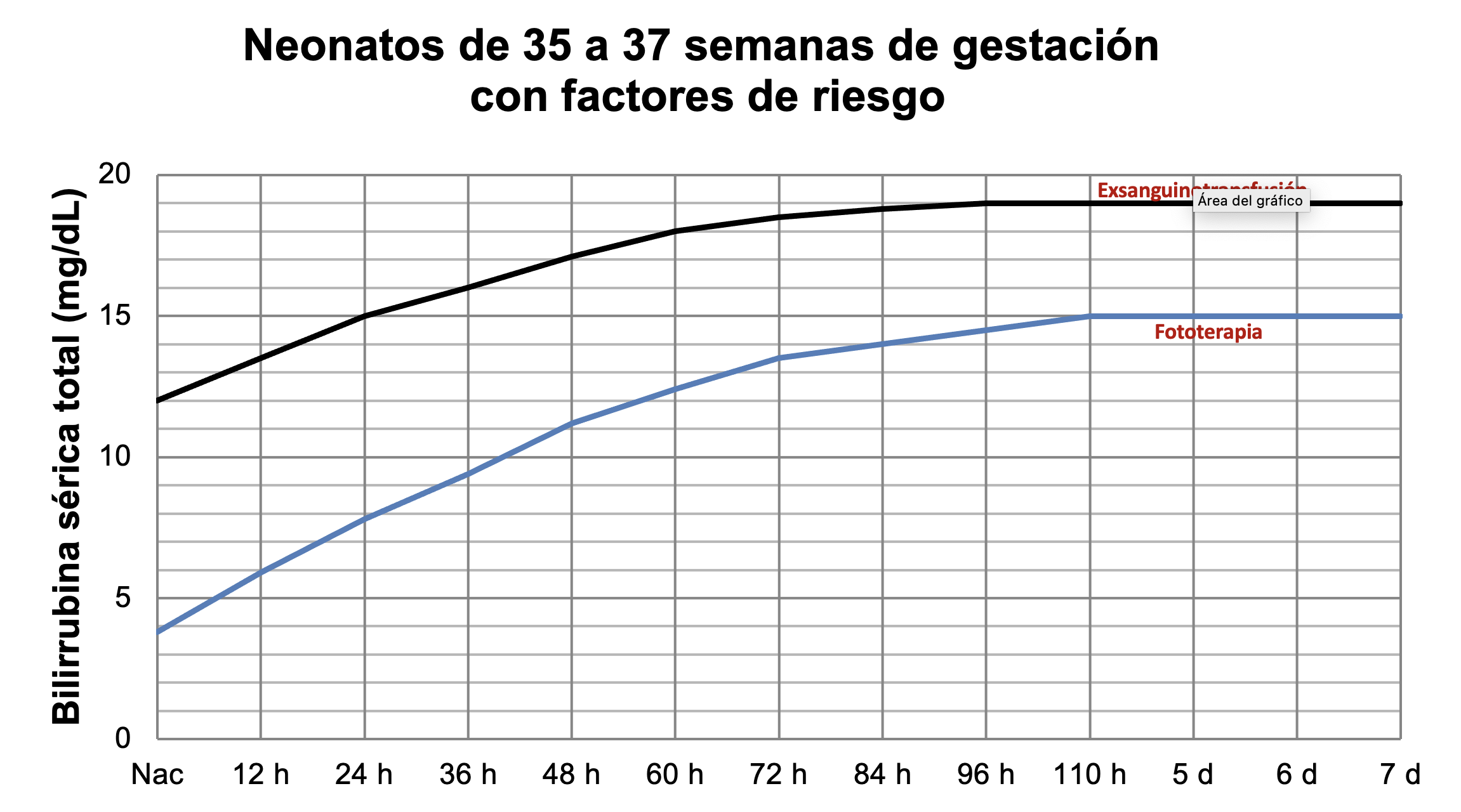
Tratamiento de ictericia en neonatos entre 35 y 37 semanas con factores de riesgo. A partir de datos de la AAP.
Figura 43
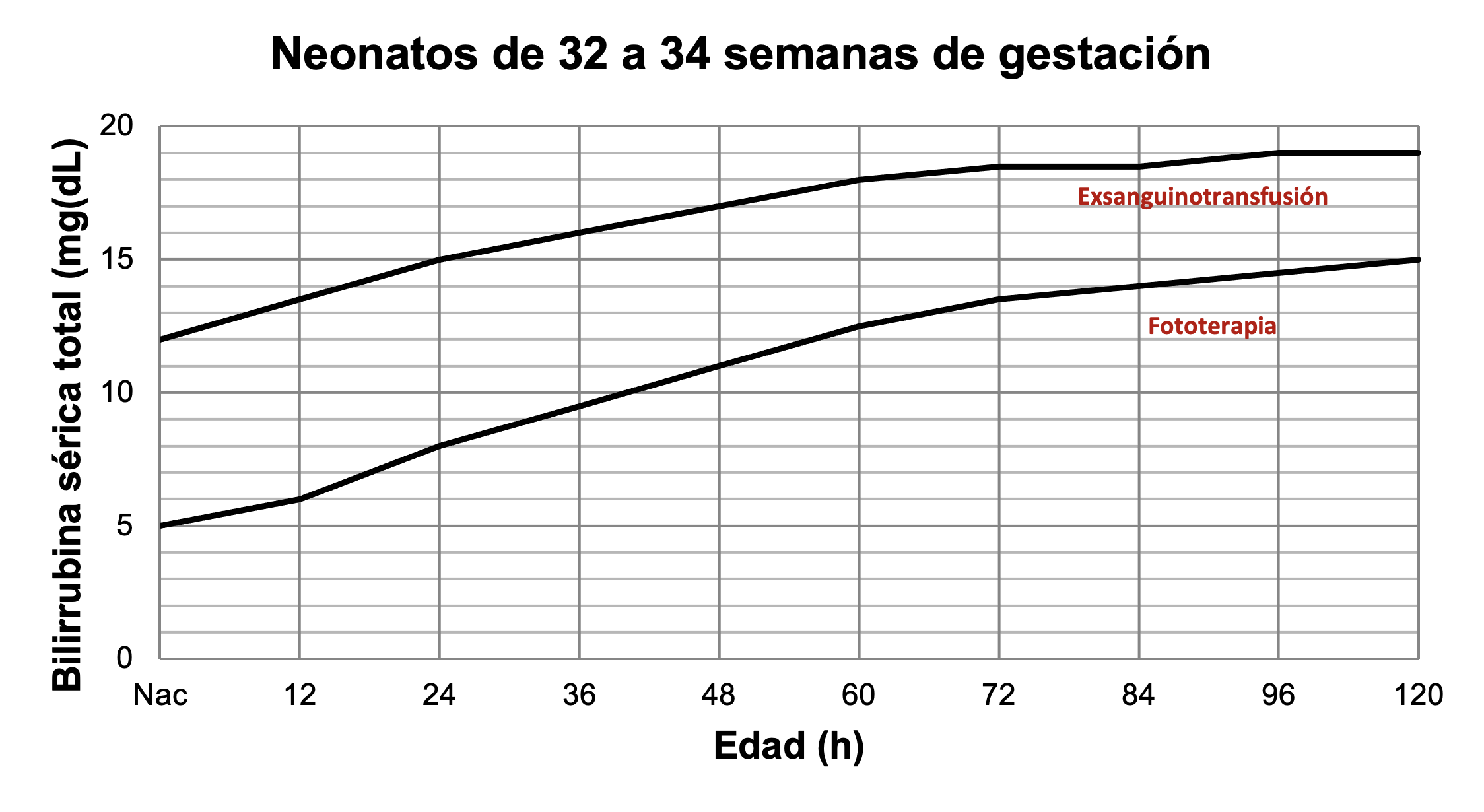
Tratamiento de ictericia en neonatos entre 32 y 34 semanas de gestación. A partir de datos de Romagnoli.
Figura 44
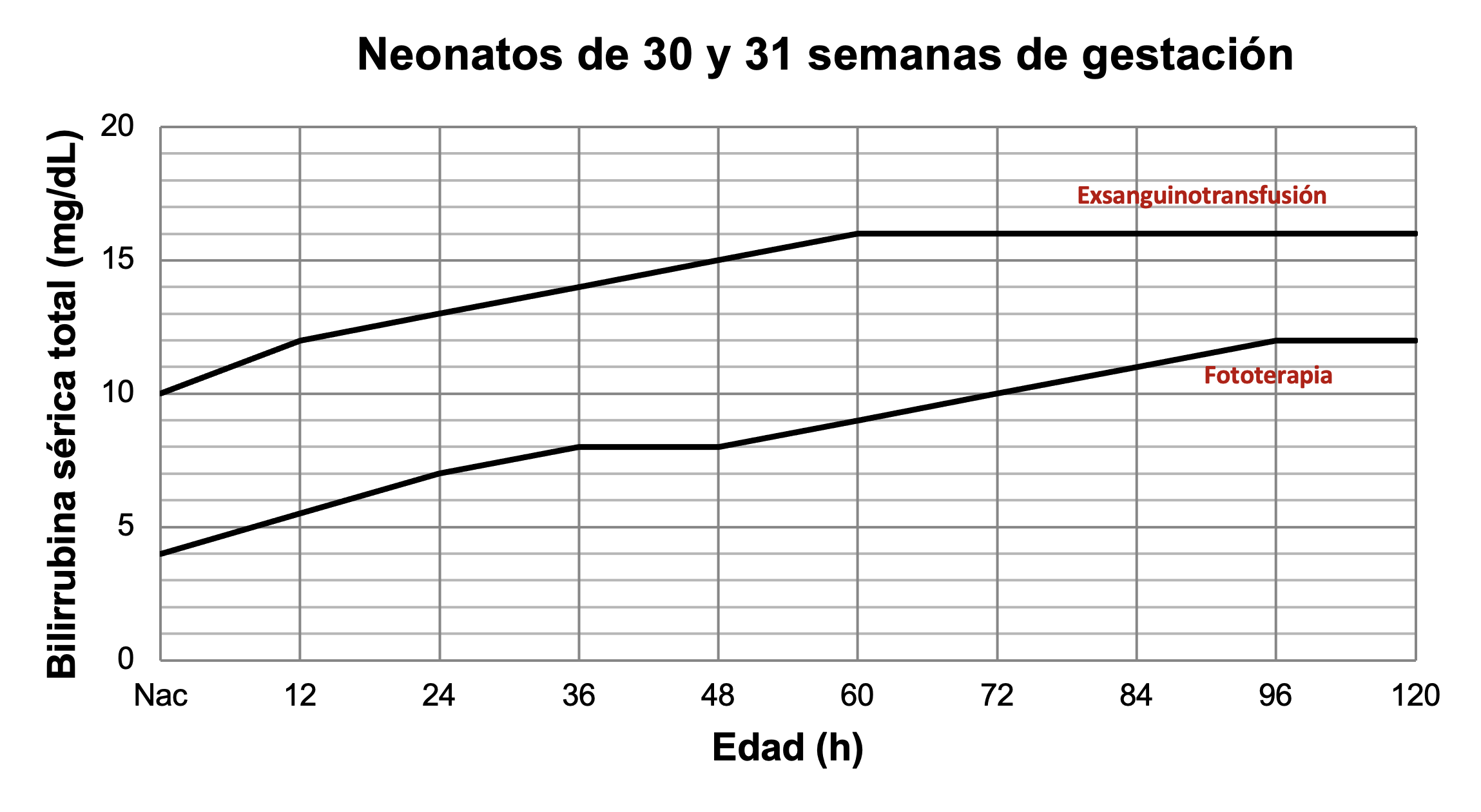
Tratamiento de ictericia en neonatos de 30 y 31 semanas de gestación. A partir de datos de Romagnoli.
Figura 45
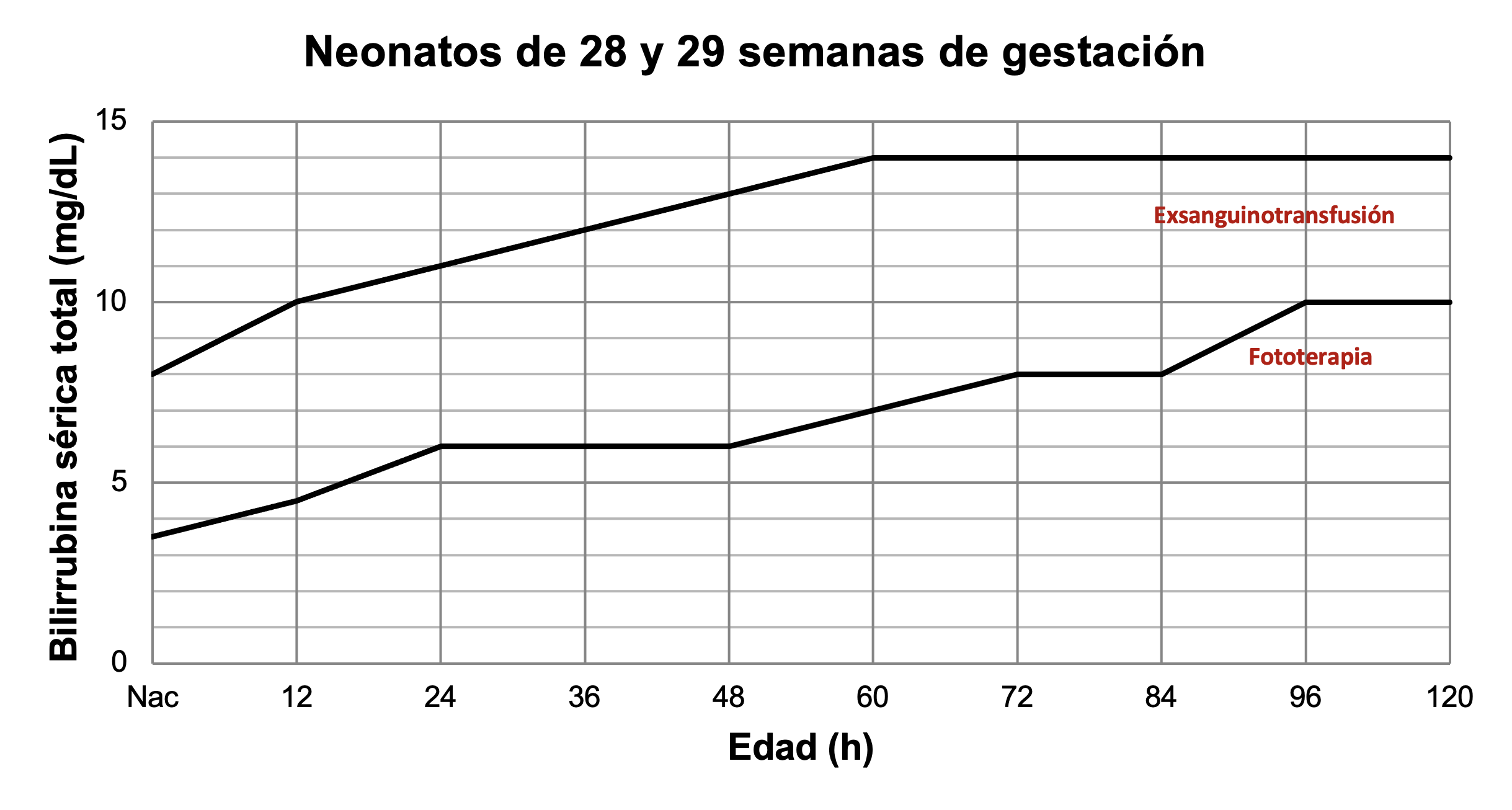
Tratamiento de ictericia en neonatos de 29 y 30 semanas de gestación. A partir de datos de Romagnoli.
Aunque se ha intentado tratamiento farmacológico de la ictericia con fenobarbital, clofibrato, gemfibrozil, carbón vegetal, agar, metaloporfirinas e infusiones herbáceas, sólo el fenobarbital ha comprobado su utilidad en forma contundente. Sólo debe usarse si no está disponible la fototerapia, ya que su efecto en conjunto con ella no ofrece un mayor beneficio que la sola fototerapia. La dosis de fenobarbital es de 10 mg/kg de peso al día repartido en dos tomas orales por tres días.
La bilirrubina libre, ácida e hidrosoluble, puede pasar las membranas celulares; cuando entra en el cerebro puede producir daño neuronal; si lo hace por tiempo prolongado, el daño puede ser irreversible. La disfunción neurológica inducida por bilirrubina (BIND, bilirubin induced-neurologic dysfunction) es un espectro de problemas neurológicos asociados a toxicidad por bilirrubina; prevenibles.
Un estudio realizado por el grupo del INP, encontró encefalopatía en 13.5% de 741 neonatos de término hospitalizados con ictericia patológica. El riesgo relativo (RR) para encefalopatía entre los que tuvieron hemólisis fue de 2.9 (IC 95 1.8-4.6); cuando la bilirrubina fue ≥ 20 mg/dL se encontró un RR 3.4 (IC 95 2-5.7) y cuando la BST fue ≥ 30 mg/dL se incrementó el RR a 11.6 (IC 95 6.5-20.6). También encontramos alteraciones en los potenciales evocados auditivos en más de la mitad de los neonatos en quienes se realizó el estudio.
Los factores que favorecen la entrada de bilirrubina al cerebro son: concentración de bilirrubina no conjugada, albúmina sérica disminuida, concentración de todas las sustancias que se unen a la albúmina y permeabilidad vascular. Los factores que potencializan el daño (factores de riesgo para daño neurológico) son hiperosmolaridad, acidosis e hipoxia; también han sido asociados la prematuridad, bajo peso al nacer, asfixia perinatal, hipotermia significativa o persistente, deshidratación, hipernatriemia, septicemia, meningitis, hemólisis, hipercapnia y presión venosa cerebral incrementada.
Las manifestaciones de encefalopatía atribuible a bilirrubina son en una primera fase: rechazo al alimento, somnolencia persistente, hipotonía y llanto agudo; si no se ofrece tratamiento, evolucionará a una segunda fase: hipertonía (retrocollis y opistótonos), fiebre, llanto agudo y estupor; la tercera fase muestra: convulsiones, coma, apnea y en algunos niños muerte.
Si el tratamiento en la primera fase se aplica con rapidez, los datos clínicos pueden ser revertidos. En caso de dejar el cerebro expuesto a bilirrubinas elevadas por periodos considerables (a más horas, más riesgo) o si el paciente tiene factores que potencializan el daño, entonces dejará secuelas neurológicas (kernicterus) que pueden incluir en su forma clásica parálisis cerebral atetoide, parálisis de la mirada hacia arriba, distonía generalizada y pérdida de la audición neurosensorial. Sin embargo, recientemente se describió la disfunción neurológica inducida por bilirrubina como un espectro que puede incluir datos sutiles como torpeza, incoordinación motora, anormalidades de la marcha, temblores finos, neuropatía disincrónica auditiva; así como problemas de atención, aprendizaje y conducta.
La falta de cuidado de las familias (en ocasiones por mala asesoría en salud) y cuidados inefectivos e insuficientes aunado a falta de opciones diagnósticas y terapéuticas en lugares de muy bajos recursos, han llevado a una inaceptablemente alta morbilidad y que aún haya defunciones (evitables) por ictericia, por lo que se invita al médico a hacer una evaluación completa e instalar rápidamente un tratamiento efectivo, cuando sea el caso.
El principal mensaje es que la encefalopatía bilirrubínica puede prevenirse y si el paciente acudió ya con datos neurológicos, puede limitarse el daño con un tratamiento agresivo inmediato.